Пусть неизвестный металл - Х.
1) Составим формулу:
Формула для нитрида двухвалентного металла ⇒

+

⇒

+
 Вставляем коэффициенты:
Вставляем коэффициенты:

+

⇒
 2) Найдём массу N ( азота ):
2) Найдём массу N ( азота ):
Масса азота = Нитрид - Х = 22,3г - 19,5г = 2,8г
3) Найдём молярную массу металла, что при помощи нам нужный металл:
N(

) =

=

= 0,1 моль
N(
) :
N(X) = 
= 0,3 моль
M(X) = 
= 65 г/моль
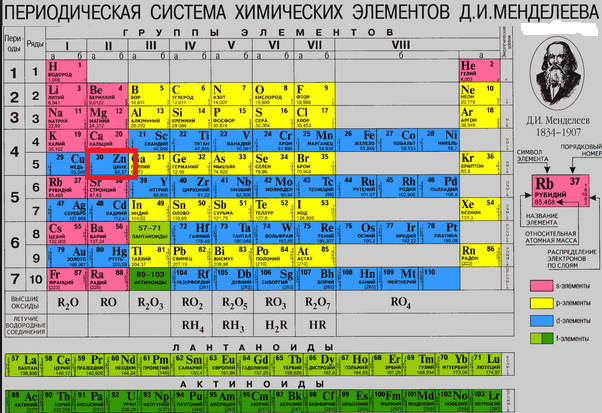
4) При помощи ТАБЛИЦЫ МЕНДЕЛЕЕВА найдём металл.
( смотри вниз в рисунок.)
Ответ: этот металл цинк.