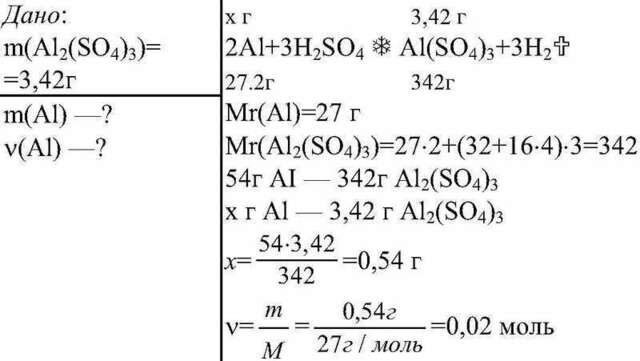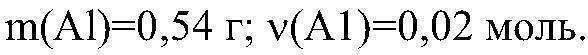х 3,42 г
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2 моля 1 моль
(Al2(SO4) 3
Решение:
М( Al2SO4)3 = 2*27 +3(32 + 4*16) = 54 + 288 = 342 г
М(Al)= 27 г
Определяем количество вещества алюминия (v). Для этого составим пропорцию:
х моль(Al)--------------------------3,42 г (Al2(SO4) 3
2 моля (Al)-------------------------342 г (Al2(SO4) 3
х = (2*3,42) / 342 = 0,02 моля (Al)
Определим массу алюминия, вступившего в реакцию:
m = v*M = 0,02 * 27 = 0,54 г
Пояснение: буква (v)-ню обозначение количества вещества.