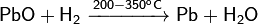H2+PbO=Pb+H20
v(количество вещества PbO)=m/Mr=16/223=0.07моль
По условию : на 1 моль водорода приходится 1 моль оксида свинца (2)
Найдем количество вещества водорода, необходимого для реакции, при помощи найденного количества вещества оксида свинца (2) и условия.
v( кол-во в-ва H2)=0.07 моль
V(объём H2)=v(колич-во в-ва H2)*V(молярный объем газов)=0.07*22.4=1.568л
Вроде бы так ^^