1)  моль
моль
 г
г
Ответ: 0,34г
2) формула: 

Ответ: 64%
3) 
1. Через массы вычисляем количество моль и узнаём, какое из них в избытке и какое в недостатке. Через недостаток можно будет найти массу соли, а избыток просто отбрасываем:
 моль - недостаток.
моль - недостаток.
 моль - избыток.
моль - избыток.
Значит, решаем через оксид магния.
2. Зная коэффициенты в уравнении, можно составить соотношение и узнать количество моль соли:
 n(MgO)=n(MgSO_4)=0,25" alt="n(MgO):n(MgSO_4)=1:1=>n(MgO)=n(MgSO_4)=0,25" align="absmiddle" class="latex-formula">моль
n(MgO)=n(MgSO_4)=0,25" alt="n(MgO):n(MgSO_4)=1:1=>n(MgO)=n(MgSO_4)=0,25" align="absmiddle" class="latex-formula">моль
3. Зная количество моль соли, можно найти её массу:
 г
г
Ответ: 30г
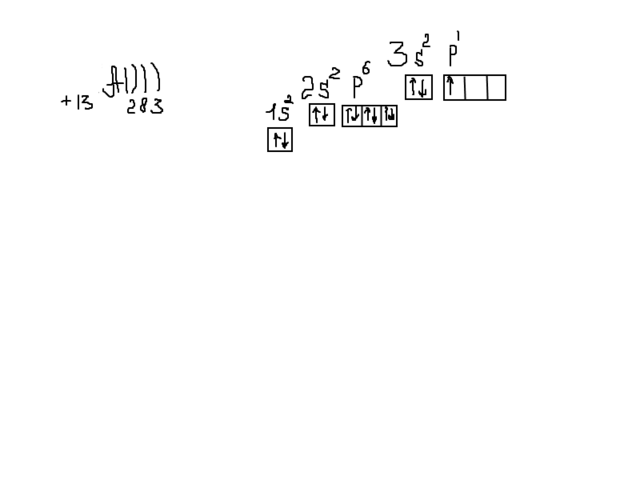
4) Во вложении смотри.
5) вариант 4 - 
6) вариант 3 -  , т.к многоосновная кислота.
, т.к многоосновная кислота.