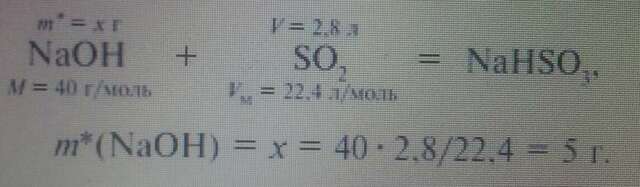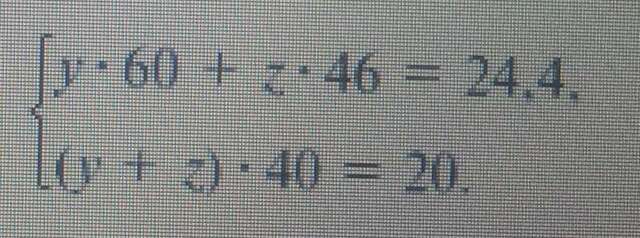Масса NaOH, содержащегося в заданном объеме V = 227,3 мл с концентрацией c(NaOH) = 10% и плотностью = 1,1 г/мл, составляет(1 рисунок)
m(NaOH) = c(%)(NaOH)••V/100(%) = 10•1,1•227,3/100 = 25 г.
Избыток щелочи (m*) найдем из уравнения реакции:
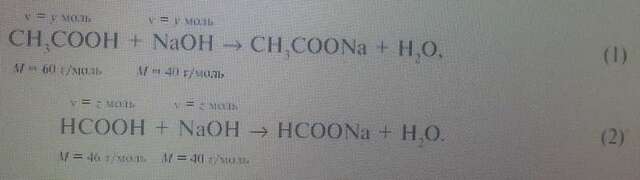
В реакции со смесью кислот НСООН и СН3СООН израсходовалось 20 г NaOH.
Обозначим количества веществ уксусной кислоты и муравьиной кислоты:
(СН3СООН) = у моль, (НСООН) = z моль.
Запишем уравнения реакций:(2 рисунок)
Расход количества вещества щелочи в реакциях (1) и (2) такой же, как у кислот. Зная общую массу смеси кислот (m(смеси) = 24,4 г) и расход щелочи (20 г), составим систему двух уравнений с двумя неизвестными:(3 рисунок)
Решая систему, найдем: у = 0,1 моль, z = 0,4 моль.
По массе это составляет:
m(CH3COOH) = 0,1•60 = 6 г,
m(HCOOH) = 0,4•46 = 18,4 г.
Концентрация в процентах по массе:
с(СН3СООН) = (6/24,4)•100(%) = 24,6%.