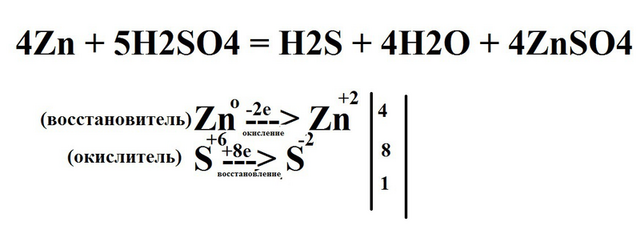Ну, начнем с того, что это окислительно-восстановительные реакции.
Чтобы их уровнять, прежде всего, нужно найти окислитель и восстановитель.
Типичные восстановители -- металлы. Они отдают электроны.
Окислителями, в основном, являются галогены (бывают, конечно, и исключения).
Прежде всего, нужно определить степени окисления у каждого элемента. (это же не нужно объяснять?)
Потом мы устанавливаем, степени окисления каких элементов изменилась до равно и после равно.
Я возьму для примера второе задание:
Определив степень окисления всех имеющихся элементов, мы можем заметить, что степень окисления изменилась у цинка и серы.
Я как-то попробовал показать, как это решается, но не знаю, поймете ли.
Цинк является восстановителем, но сам процесс называется окисление (не путать!). Цинк отдает два электрона, чтобы восстановить в-во.
Сера же окислитель, наоборот, принимает электроны.
У цинка изменилась ст. окисления с 0 до +2, значит он отдал два электрона. У серы с +6 меняется до -2, значит, сера приняла 8 электронов.
Дальше мы ищем наименьшее общее кратное (тут мы берем 8, т.к. делится и на 8 и на 2 целиком).
К сожалению, этот момент я не смог расписать в пайнте, но
Полученные числа при делениии 8 на 8 и 8 на 2 мы записываем перед цинком и серой сначала в ОВР, а потом и в самой реакции. Потом уже начинаем уравнивать. Проверяем, уравнено ли уравнение по кислороду.
Вот и все, вроде как.