Сила кислот обуславливается возможностью ионов/иона H+ "отсоединиться" от кислоты. Такую тенденцию можно наблюдать в ряду HCl-HBr-HJ (происходит увеличение силы кислоты, так как радиус атома-галогена растёт и иону H+ будет проще отсоединиться)
Теперь объясню более простым языком на твоем вопросе:
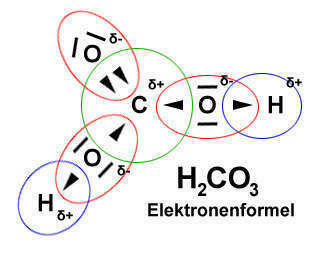
В приведённом ряду самый электроотрицательный- это атом C с зарядом δ+, поэтому "товарищ" O с зарядом δ- не очень-то и хочет смещаться в сторону углерода, а наоборот- теснится к H+, который менее электроотрицательный, чем углерод
Именно поэтому в растворах угольная кислота распадается на CO2 и H2O, а H2CO3 - это грубое её обозначение
В твоём ряду у атомов с зарядом δ+ падает электроотрицательность, поэтому кислород всё больше и больше теснится к ним ,связь с H+ ослабевает, делая кислоту сильнее