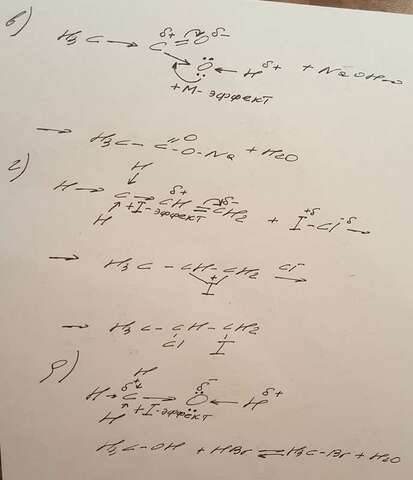А)
Хлорметан. Здесь будет -l-эффект атома хлора. Хлор , как более электроотрицательный элемент по сравнению с карбоном будет стягивать на себя электронную плотность метильной группы. Карбон будет приобретать частично положительный заряд,а атом хлора-частично отрицательный. На примере механизма SN1 (мономолекулярного нуклеофильного замещения) показано как эффект будет влиять на реакционную способность хлорметана. Это реакция гидролиза под действием водного р-ра щелочи с образованием спиртов.
1) Изначально произойдет электролитическая диссоциация. Хлорметан диссоциирует на карбокатион и анион хлора.
2) Далее карбокатион с обделенной электронной плотностью прореагирует с гидроксо-анионом,обладающим неподеленной электронной парой. Получится метанол.
3) анион хлора прореагирует с протоном.
б) толуол. Здесь +l-эффект. Метильная группа будет смещать электронную плотность в сторону бензольного кольца, т.е. она обладает электродонорными свойствами(т.к. у нас sp2 гибридизованные атомы углерода более электроотрицательны чем sp3 гибридизованный карбон). Она активирует бензольное кольцо. -CH3 группа будет облегчать вхождение электрофильных реагентов в бензольное кольцо в орто- и пара-положениях. Почему именно в этих положениях? Это связано и с индуктивным эффектом,и с эффектом сопряжения иначе - мезомерного эффекта. Сигма-связи С-Н метильной группы могут участвовать в сверхсопряжении с пи-электронной системой ароматического ядра (сигма-пи сопряжение). Распределение электронов можно представить как промежуточное между пятью граничными структурами, где в главной степени отрицательный заряд будет сосредоточен в орто и пара положениях. Результат такого сопряжения это и
• упрочнение С-С связи между карбоном метильной группой и карбоном ароматического ядра. Будет происходить перекрывание взаимодействующих орбиталей.
• повышение полярности С-Н связей метильной группы = увеличение ее кислотности.
Показать облегчение вхождения в орто и пара положениях электрофильных реагентов в кольцо можно на примере нитрования.
в) здесь будет наблюдаться +M-эффект атома кислорода гидроксильного фрагмента. Этот эффект характерен для групп повышающих электронную плотность в системе сопряжения т.е. тех групп,которые обладают неподеленной электронной парой и способных отдавать ее в общую систему сопряжения.
Атом кислорода -OH группы будет иметь неподеленную электронную пару на своей p-орбитали. +M-эффект будет гасить частичный положительный заряд на атоме карбона -COOH группы. Разумеется при таком раскладе реакции присоединения уже неуместны(в сравнении с карбонильными соединениями),но зато полярность O←H связи увеличивается. Протон более подвижнее , он проще отщепляется(в сравнении со спиртами) кислотные свойства усиливаются. Показать это можно на примере простой реакции нейтрализации(кислота+основание).
г) пропен. Здесь наблюдается +l-эффект -CH3 группы. Как и в случае толуола. Происходит это из-за разницы в электроотрицательности атомов sp3 гибридного карбона и sp2 гибридных карбонов. Из-за электронного вторжения пи-связь,как наиболее подвижная будет смещаться к самому крайнему атому карбона. Происходит поляризация двойной связи. В результате центральный атом карбона имеет частично положительный заряд,а терминальный-частично отрицательный. Поляризацию атомов карбона вследствии +l-эффекта можно показать на примере присоединения смешанных галогенов. Здесь стадийность присоединения будет определяться разностью зарядов атомов галогенов т.е. их полярностью,а раз в пропене связи тоже полярные , то соответственно иод с зарядом плюс пойдет к терминальному карбону,хлор с зарядом минус - к центральному.
д) здесь будет наблюдаться +l-эффект метильной группы поэтому даже несмотря на то,что кислород будет стягивать электронную плотность с водорода на себя(как более электроотрицательный атом) и связь будет поляризовываться она все равно будет менее полярной чем в воде т.к. избыток электронной плотности электродонорного метильного радикала будет делать атом водорода менее подвижным,а значит и связь O-H менее полярной поэтому как кислота метанол будет очень слабой даже по сравнению с водой.
Атом кислорода как более электроотрицательный стянет всю электронную плотность на себя. С-О и О-Н связи будут поляризовываться. Так как карбон связанный с -OH группой будет обладать дефицитом электронной плотности он становится объектом атаки нуклеофильным реагентом. Будет разрываться связь C-O. Можно показать на примере реакции с HBr.