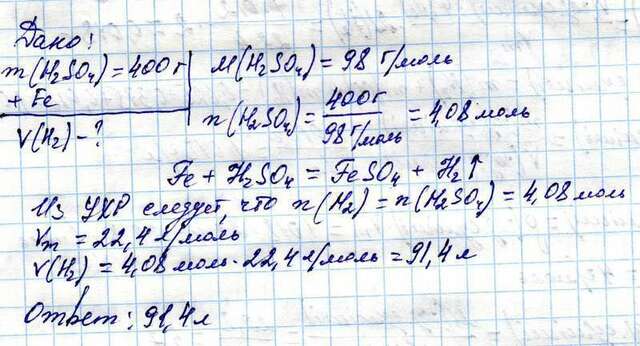Дано:
m(p-pa H2SO4) = 400 г
ω(H2SO4) = 9.8% или 0,098,
+ Fe
Найти:
V(H2)-?
m(H2SO4)=400 г*0,098 = 39,2 г
n(H2SO4)= 39,2 г/98 г/моль = 0,4 моль
Fe + H2SO4 = FeSO4 + H2↑
Из УХР следует, что n(H2)=n(Fe)
n(H2) = 0,4 моль
Vm=22,4 л/моль
V(H2)=0,4 моль*22,4 л/моль = 8,96 л
Ответ: 8,96 л
В приложении задача решена при условии, что раствор содержит 400 г серной к-ты.