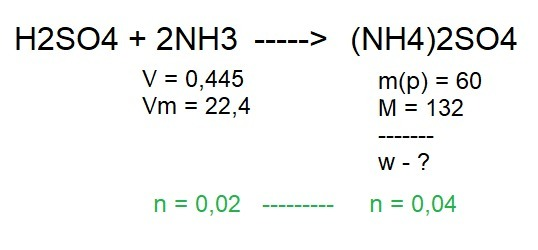
Для начала напишем уравнение реакции и проставим коэффициенты (2 перед NH3). Это тоже считается как "дано".
Зелёным я выделил то, что мы получим далее - количество молей.
1) По условию у нас есть объём газа NH3. Молярный объём всегда 22,4 для любого газа, из чего получаем количество молей по формуле:
 (моль)
(моль)
Т.к перед NH3 стоит коэффициент 2, то
n (NH4)2SO4 как 2:1 = 0,01 моль
2) Теперь вычислим массу чистого вещества для (NH4)2SO4:
 M = 1,32" alt=" m_{1} = [tex] n ·M = 1,32" align="absmiddle" class="latex-formula"> (г)
M = 1,32" alt=" m_{1} = [tex] n ·M = 1,32" align="absmiddle" class="latex-formula"> (г)
3) И вычисляем то, что искали:
ω =  = 2,2%" alt=" \frac{ m_{1} }{ m_{2} } ·100% = \frac{1,32}{60} = 2,2%" align="absmiddle" class="latex-formula">
= 2,2%" alt=" \frac{ m_{1} }{ m_{2} } ·100% = \frac{1,32}{60} = 2,2%" align="absmiddle" class="latex-formula">
Ответ: 2,2%