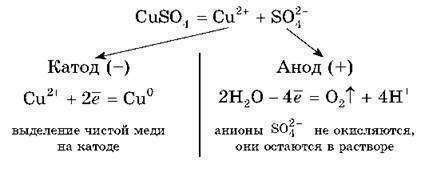
1. А,Г,Б,Д,Е,Ж,З
2. 2HNO3 = 2NO + O2 + H2O
+5 +4
N+ e -> N окислитель
-2 0
O - 2e ->O восстановитель
3. 1б) 2а) 3а) 4б) 5а)
4. повышение температуры, понижение давления, уменьшение концентрации СО
5. ZnCl2 + Na2S --> ZnS + 2NaCl
Zn2+ + S2- --> ZnS
Na2CO3 + CaCl2 --> CaCO3 + 2NaCl
Ca2+ + CO32- --> CaCO3
6. CaCl2 не гидролизует
Ni(NO2)2 + H2O --> Ni(OH)2 + HNO2 (слабое основание и слабая кислота)
7.