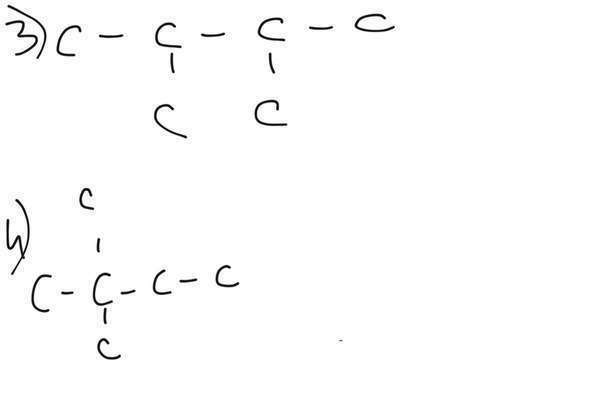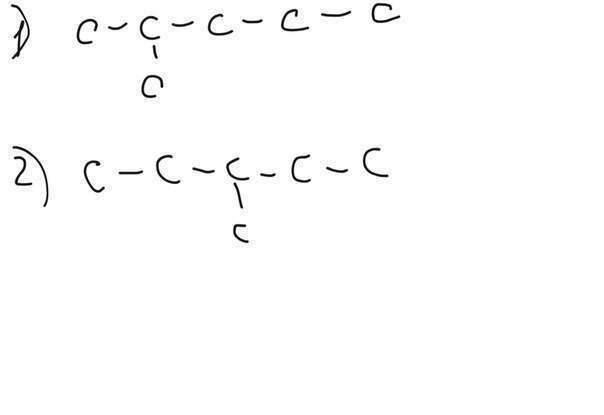Дано:
m(CxHy) = 8,6г
m(CO2) = 26,4г
m(H2O) = 12,6г
Dвозд = 2,966
Найти:
CxHy = ?
CxHy + (2x+y/2)/2O2 = xCO2 + y/2H2O
1) M(CxHy) = Dвозд * Mвозд = 2,966*29 = 86 г/моль
2) n(CO2) = m/M = 26,4/44 = 0,6
n(C) = 0,6 моль
3) n(H2O) = m/M = 12,6/18 = 0,7
n(H) = 1,4 моль
4) x:y = C:H = 0,6 : 1,4 = 6:14 = C6H14 (гексан)
Изомеров у него много, нарисую 4 (во вложении)
1) 2-метилпентан
2) 3-метилпентан
3) 2,3-диметилбутан
4) 2,2 - диметилбутан