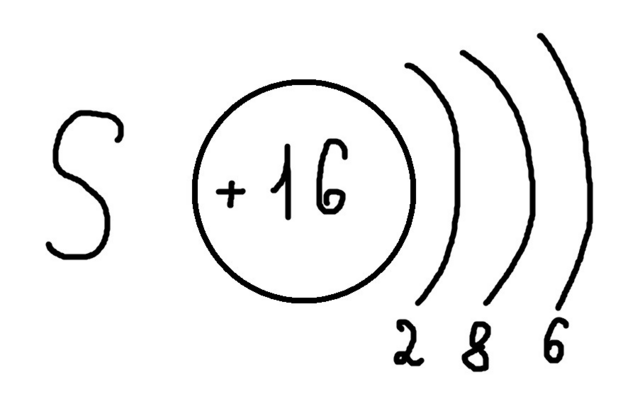Определить количество энергетических уровней можно по номеру периода элемента. Количество электронов в ядре = порядковый номер.
Например He находится в первом периоде, значит у него 1 энергетический уровень.
Спины (стрелочки) - это электроны, в одной клеточке может быть только 2 электрона, они всегда размещаются по принципу Паули, короче говоря ⇅ и никак иначе.
Существует 4 вида подуровней:
s - на нем максимальное кол-во электронов 2 (1 квадратик)
p - на нем максимальное кол-во электронов 6 (3 квадратика)
d - максимальное кол-во электронов 10 (5 квадратиков)
f - максимальное кол-во электронов 14 (7 квадратиков)
На первом энергетическом уровне максимальное кол-во 2 электрона (только s-подуровень).
На втором уровне максимально 8 электронов (один S и один p подуровни)
На третьем максимально 18 электронов ( S, p и d подуровни)
На четвертом максимально 32 электрона ( s, p, d, f подуровни)
У Гелия только один энергетический уровень, значит у него только 1s подуровень, на котором и разместятся его 2 электрона.
Возьмем еще как пример Серу S.
Порядковый номер 16, значит заряд ядра +16, и, получается, 16 электронов.
Сера находится в третьем периоде, поэтому у нее три энергетических уровня.
Значит у нас есть 16 электронов.
На первом уровне макс. число электронов 2, поэтому пишем 2.
У нас остается еще 14 электронов.
На третьем уровне макс. число электронов 8, поэтому пишем 8.
У нас остается 6 электронов, которые мы ставим на оставшемся третьем уровне.
И схема строения ядра у нас получается такой (фото 1).
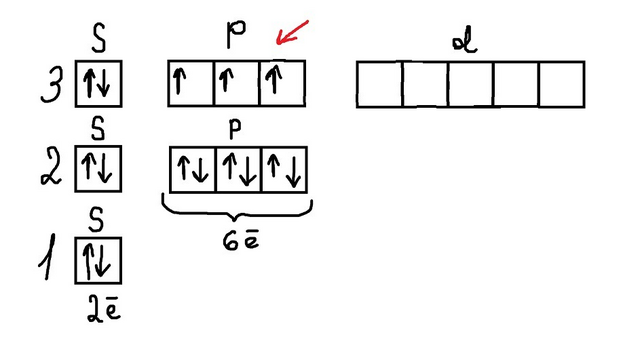
Теперь составим электронную конфигурацию.
Еще один важный момент, расставлять спины (стрелочки) на ПОДУРОВНЕ нужно по одной, а потом спаривать с оставшимися.
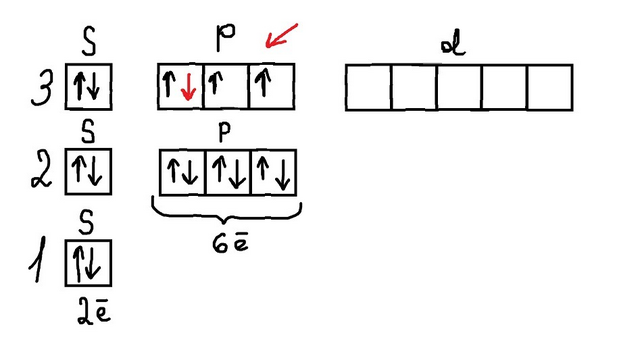
То есть как на фото 2. Сначала мы на 3p подуровне (на котором максимальное кол-во электронов 6) пишем по одной стрелочке, в итоге у нас остается 1 электрон (так как на третьем уровне у нас 6 электронов всего, и 2 из них на 3s подуровне) и мы их начинаем спаривать (фото 3).
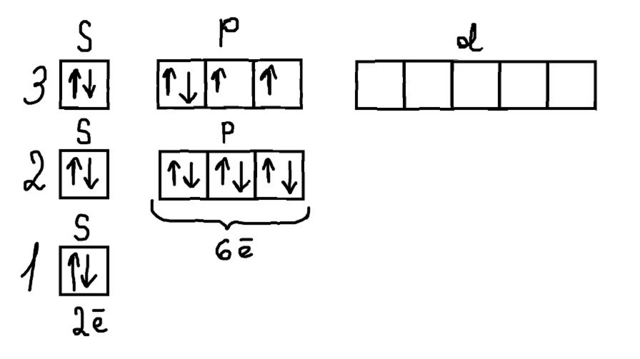
В итоге у нас есть электронная конфигурация (фото 4). d-подуровень пустой, поэтому его можно даже не рисовать.
Теперь нужно составить электронную формулу по ней.
Смотрим. На первом уровне у нас 1s подуровень с 2 электронами, значит записываем 1s².
На втором уровне у нас 2s и 2p подуровни, на 2s у нас 2 электрона, а на 2p их 6, значит это 2s² 2p⁶.
В итоге у нас уже есть часть формулы 1s² 2s² 2p⁶
На третьем уровне у нас заполнены 3s и 3p подуровни, на которых, соответственно, 2 и 4 электронов. Получается 3s² 3p⁴.
В итоге мы имеем электронную формулу серы: 1s² 2s² 2p⁶ 3s² 3p⁴